Rot oder Grau?
 |
| Quelle: Pixabay |
War die Antike strahlend weiß? Wir alle kennen die klassischen griechischen Statuen in weißem Marmor. Allerdings haben sie nicht immer so ausgesehen. Die meisten dieser Statuen waren ursprünglich bunt bemalt. Der Zahn der Zeit hat die Farben abgetragen, aber mit modernen Analysemethoden kann man häufig noch die Farben und deren Komponenten nachvollziehen.
[Wer übrigens in Frankfurt und Umgebung wohnt: Diese farbigen Statuen sind das Thema der aktuellen Ausstellung „Bunte Götter“ im Frankfurter Liebieghaus und auf jeden Fall einen Besuch wert – sobald dies wieder möglich ist.]
Frage (Klassenstufen 7-10, E und Q)
Anorganische Farbpigmente wurden seit der Antike häufig verwendet. Sie bestehen aus farbigen Stoffen, die frei von Kohlenstoffverbindungen sind. Meist sind Metalle die farbgebenden Elemente. Ihr Vorteil ist, dass sie in der Regel sehr stabil sind und so die Jahrhunderte überdauern – meistens jedenfalls.
Nicht wenige Beispiele für anorganische Farbpigmente sind im Laufe dieses Wettbewerbes schon erwähnt worden. Erinnert ihr euch? Ein wenig Wiederholung schadet sicher nicht.
Nennt anorganische Pigmente-Beispiele für folgende Farben – Ihr dürft Euch aus den vorherigen Fragen bedienen:
grün:
Lösung:
Malachit, Grünspan – Frage 2 Himmelsscheibe von Nebr
a oder Schweinfurter Grün – Frage 5 - Feuerwerk
gelb:
Lösung:
Antimongelb – Frage 3 – eine Armee für die Ewigkeit
blau:
Lösung:
Kobaltblau – Frage 3 – eine Armee für die Ewigkeit
weiß:
Lösung:
Bleiweiß/2 PbCO3 • Pb(OH)2 – Frage 1 – Kunstfälschern auf der Spur
Frage (Klassenstufen 8-10, E und Q)
Die Farbe Rot kam bisher nicht vor. Das wollen wir jetzt ändern. Eine Verbindung, die als Rotpigment genutzt werden kann, ist Zinnober (HgS). Obwohl anorganische Farbpigmente an sich sehr stabil sind, wurde an einigen Kunstwerken eine graue Nachfärbung des Zinnobers beobachtet. Deutlich wird dies zum Beispiel in dem Gemälde „Giovanni dal Ponte: Saints Peter, Romuald, Catherine and Jerome“ der National Gallery auf der rechten Robe in der Höhe des Halses des Heiligen Hieronymus (reinzoomen).
Als Ursache für diese Nachfärbung vermutet man, dass Zinnober durch UV-Licht Einstrahlung in eine metastabile, schwarze HgS-Modifikation umgewandelt wird und dadurch die Eingrauung entsteht.
Eine Modifikation - was ist das? Füllt den Lückentext aus:
(Die Tiefstellung bei O2 und O3 könnt ihr ignorieren)
O2 - Allotropie - Temperatur - Korund - O3 - Energie - Kohlenstoff - Druck
Von Modifikationen verschiedener Elemente oder Verbindungen spricht man, wenn sich der gleiche Stoff aufgrund unterschiedlicher Struktur in physikalischen oder chemischen Eigenschaften unterscheidet. Bei Modifikationen von Elementen spricht man von
Lösung:
Allotropie
. Das bekannteste Beispiel ist wohl der
Lösung:
Kohlenstoff
. Das Element kann in unterschiedlichen Gittern einmal als Graphit und einmal als Diamant auftreten. Aber auch Sauerstoff besitzt verschiedene Modifikationen. Neben dem für uns lebenswichtigen
Lösung:
O2
-Molekül gibt es das Ozon mit der Formel
Lösung:
O3
. Ein Beispiel für Modifikationen einer Verbindung ist Aluminiumoxid, das als Tonerde oder
Lösung:
Korund
vorkommen kann.
Einflüsse wie Druck oder Temperatur oder im Falle unseres Zinnobers auch
Lösung:
Energie
aus Licht können dafür sorgen, dass eine Modifikation in eine andere umgewandelt wird. So entsteht aus Graphit unter hohem
Lösung:
Druck
Diamant. Metallisches β-Zinn wird bei niedriger
zu grauem, bröseligen α-Zinn umgewandelt. Man sprach früher von der Zinnpest, wenn im Winter das Besteck in der Schublade zerbröselte oder die Zinnknöpfe von der Jacke fielen.
Lösung:
Temperatur
Kompletter Text:
Von Modifikationen verschiedener Elemente oder Verbindungen spricht man, wenn sich der gleiche Stoff aufgrund unterschiedlicher Struktur in physikalischen oder chemischen Eigenschaften unterscheidet. Bei Modifikationen von Elementen spricht man von Allotropie. Das bekannteste Beispiel ist wohl der Kohlenstoff. Das Element kann in unterschiedlichen Gittern einmal als Graphit und einmal als Diamant auftreten. Aber auch Sauerstoff besitzt verschiedene Modifikationen. Neben dem für uns lebenswichtigen O2-Molekül gibt es das Ozon mit der Formel O3. Ein Beispiel für Modifikationen einer Verbindung, ist Aluminiumoxid, das als Tonerde oder Korund vorkommen kann. Einflüsse, wie Druck oder Temperatur, oder im Falle unseres Zinnobers auch Energie aus Licht können dafür sorgen, dass eine Modifikation in eine andere umgewandelt wird. So entsteht aus Graphit unter hohem Druck Diamant. Metallisches β-Zinn wird bei niedriger Temperatur zu grauem, bröseligen α-Zinn umgewandelt. Man sprach früher von der Zinnpest, wenn im Winter das Besteck in der Schublade zerbröselte oder die Zinnknöpfe von der Jacke fielen.
Frage (Klassenstufen 9-10, E und Q)
Die Energie für die Umwandlung von Zinnober in die metastabile HgS-Modifikation kommt also aus dem Licht, dem das Kunstwerk ausgesetzt ist. Das Licht welcher Wellenläge ist wohl für die Vergrauung des Zinnober verantwortlich?
Sortiert die angegebenen Wellenlängen des Lichts in der Reihenfolge eines abnehmenden Energiegehalts:
λ(lambda)=520 nm, λ=700 nm, λ=355 nm
Lösung:
λ=355 nm, λ=520 nm, λ=700 nm
gebe die jeweilige Farbe des Lichts an:
λ=520 nm
Lösung:
grün
λ=700 nm
Lösung:
rot
λ=355 nm
Lösung:
UV-Licht
Frage (Klassenstufen 10, E und Q)
Wieso aus rotem Quecksilbersulfid graues wird, kann man auch mit Hilfe der Thermodynamik erklären.
Die (thermodynamische) Stabilität beschreibt den Aufwand, der nötig ist, um eine Änderung des Zustandes (in diesem Fall der Kristallstruktur) herbeizuführen.
Ein thermodynamisch stabiler Zustand ist der Zustand der niedrigsten Energie, den jede Substanz von sich aus anstrebt. Thermodynamisch instabil ist ein Zustand, der spontan versucht, in einen stabileren Zustand, also einen mit niedrigerer Energie, überzugehen. Thermodynamisch metastabil ist ein Zustand, der sich nicht spontan ändert, falls jedoch durch die Zuführung einer kleineren Menge Energie eine Änderung ermöglicht, kann sich der Zustand ändern – man muss dem System sozusagen einen Schubs geben.
Welches der folgenden Bilder stellt für den blauen Ball einen stabilen, metastabilen und instabilen Zustand dar?
| Zustand A | 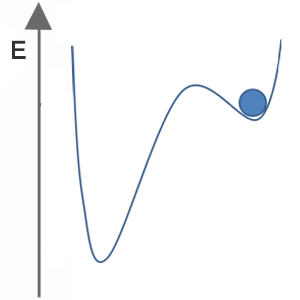 |
|---|---|
| Zustand B | 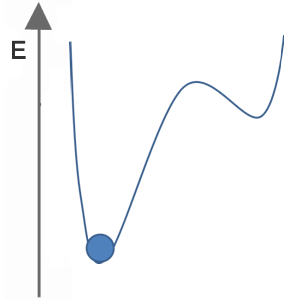 |
| Zustand C | 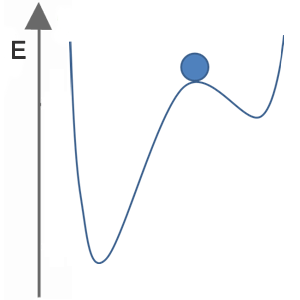 |
Zustand A:
stabil
metastabil
instabil
Lösung:
metastabil
Zustand B
stabil
metastabil
instabil
Lösung:
stabil
Zustand C
stabil
metastabil
instabil
Lösung:
instabil
Thermodynamisch stabil ist die Modifikation einer Substanz, die unter den gegebenen Bedingungen (P, T) den energetisch tiefsten Punkt darstellt (globales Minimum).
Thermodynamisch instabil ist eine Modifikation, die sich nicht in ihrem energetisch tiefsten Punkt unter den gegebenen Bedingungen (P, T) befindet. Die Substanz wandelt sich spontan in ihre stabilere Modifikation um.
Thermodynamisch metastabil sind Modifikationen, die sich energetisch in einem lokalen Minimum befinden, aber durch einen stärkeren energetischen Anreiz dazu gebracht werden kann, sich zu verändern.
Frage (Klassenstufen E und Q)
Ist damit schon geklärt, warum die schönen roten Bilder und Statuen grau werden?
Nicht ganz. Als Ursache werden auch andere chemische Reaktionen vermutet. Neuere Untersuchungen führten zum diesem Vorschlag:
Der Grund für die Vergrauung könnte eine Reaktion mit Chlorid sein.
(In der Luft ist immer ein bisschen Chlorid vorhanden.)
Das entstehende Hg2Cl2 (Kalomel) ist weiß, während die metastabile HgS-Verbindung schwarz ist (man nannte diese Verbindung früher auch „Quecksilbermohr“), daher entsteht eine Grau-Färbung.
Vervollständigt die Raktionsgleichungen:
3 HgS + _________ --> Hg3S2Cl2 +H2S
Lösung:
3 HgS + 2 HCl --> Hg3S2Cl2 +H2S
Hg3S2Cl2 + UV-Licht --> Hg2Cl2 + S + ______ (schwarz)
Lösung:
Hg3S2Cl2 + UV-light --> Hg2Cl2 + S + HgS (schwarz)
Frage (Klassenstufe Q)
Das weiße Hg2Cl2 färbt sich ebenfalls unter Lichteinfluss dunkel bis schwarz. Ursache ist die Bildung von elementarem Quecksilber gemäß folgender Gleichung:
Hg2Cl2 --> Hg + HgCl2
Ordnet die Oxidationszahlen den jeweiligen Atomen in der Gleichung zu, indem ihr die Oxidationszahlen in Klammern hinter das jeweilige Edukt/Produkt der Reaktion schreibt!
Die Hoch- und Tiefstellung dürft ihr ignorieren.
Beispiel für die Schreibweise: NaCl (+I, -I) oder H2O (+I, -II)
Lösung:
Hg2Cl2 (+I, -I) --> Hg (0)+ HgCl2 (+II,-I)
Was passiert mit dem Quecksilber?
Lösung:
Es entstehen Quecksilber und eine Quecksilberverbindung mit unterschiedlichen Oxidationszahlen. Das Quecksilber aus dem Kalomel wird in dieser Reaktion sowohl oxidiert als auch reduziert.
Wie nennt man eine solche Reaktion?
Lösung:
Diesen Vorgang nennt man Disproportionierung.